はじめに
製薬企業はリアルワールドデータ(RWD)を開発、安全性、マーケティングなどに活用しています。特に、規制当局が関与するような有効性・安全性の研究では、データの質の担保が重要となります。このような研究を実施する場合、研究計画や結果の位置付けは規制当局の担当者と相談・交渉しながら固めていきます。RWDの利活用を推し進めているアメリカ食品医薬品局(FDA)のウェブサイトで閲覧できる品目毎のReviewには、企業が考えた研究の研究計画に対し、FDA がどのように考え、企業にどのようにRecommendationしたかが載せられていることがあります。1)今回は、実際のReviewを見ながら、RWD/RWEを活用した薬事承認に対するFDAの考え方に注目してみます。
FDA品目毎のReview検索方法
FDAで承認された医薬品の添付文書(label)やreviewなどを検索するサイトはDrugs@FDA: FDA-Approved Drugs(https://www.accessdata.fda.gov/scripts/cder/daf/)です。 例として、2019年4月にRWDのみに基づき、男性乳癌への適応拡大が承認されたCDK4/6阻害薬のIBRANCE®(Palbociclib)を検索します。
1.「Search by Drug Name, Active Ingredient, or Application Number*」の検索窓に”IBRANCE”と入力し、Searchボタンをクリックします。
2. 検索結果の”IBRANCE(PALBOCICLIB)”をクリックします。
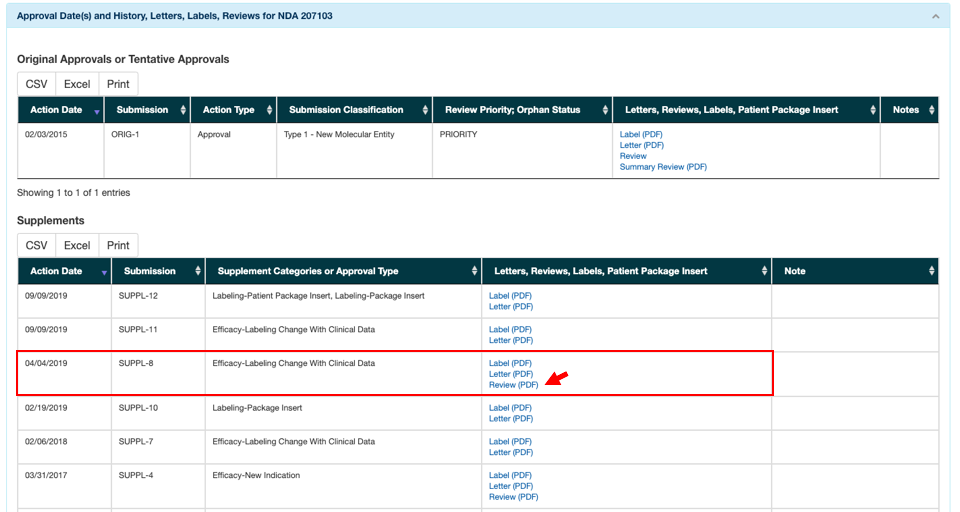
3. “Approval Date(s) and History, Letters, Labels, Reviews for NDA 207103”のタブ内にある、04/04/2019の”Review(PDF)”をクリックするとReviewを閲覧することができます。(https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/207103Orig1s008.pdf)
4. ”APPROVAL LETTER”の章の次に”MULTI-DISCIPLINE REVIEW”の章が続きますので、こちらを見てみましょう。
”MULTI-DISCIPLINE REVIEW”の目次を見てみると”Statistical and Clinical and Evaluation ”に各DBを用いた研究計画などが書かれています。

男性乳癌への適応拡大 IBRANCE®
3つのデータベースを利用
IBRANCE®の男性乳癌への適応拡大には、以下の3つのデータベースを用いて奏効率、治療継続期間、安全性の評価が行われました。
- Flatiron Health EHR data
Flatiron社が保有する米国のがん医療機関のFlatiron Provider Network内で収集されたElectronic Health Records(EHR)データから作成 - IQVIA claims data
IQVIA社が保有する保険請求データベース - Pfizer global safety DB
Pfizer社が自社で保有する安全性管理データベース
データの質へのレビュー
こちらのReviewではデータの質に注目してみます。”Data Quality and Integrityt”にReviewerのコメントが書かれています。
Flatiron Health EHR dataとPfizer global safety DBは、臨床試験の実施に関する重大な欠陥はなく、データの品質と整合性は良好と判断されています。
IQVIA claims dataは、Pfizer社のプログラマーが、転送されたファイルの数量およびデータセットの仕様/変数(試験計画書に記載)をIQVIA 社に確認したと述べています。また、データはHIPAA(Health Insurance Portability and Accountability Act:医療保険の相互運用性と説明責任に関する法律)に準拠したプロセスで収集されIQVIA社の保護されたサーバーに保存されていることが書かれています。
再発または難治性の多発性骨髄腫治療薬 XPOVIA®
次は再発または難治性の多発性骨髄腫治療薬 XPOVIA®(Selinexor)のMulti-Discipline Reviewです。(https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/212306Orig1s000MultidisciplineR.pdf)
本研究でRWDはエビデンスとして不十分と判断された
こちらは、単群非盲検試験(STORM試験)で得られた生存期間と比較するために、Flatiron Health Analytic Database(FHAD)のEHRデータを用いてレトロスペクティブな観察研究が行われました(KS-50039 試験)。
しかしながら、この研究は下記の問題点が指摘され、STORM試験の比較対照としては不十分で補助データしても使えないと結論づけられました。
RWD活用デザインの問題点
Multi-Discipline Review p83の「7.2.6 KS-50039 (Retrospective observational study using real-world data)」にその詳細が書かれています。2)
- 実施計画書と統計解析計画書の事前提出の問題(p.83 “Overview and Objective”)
FDA はデータパッケージにRWEを含める場合、透明性と妥当性評価を高めるため、実施計画書と統計解析計画書(SAP)を試験開始前に提出することを要求しています。しかし、今回のケースではFDAへの実施計画書と統計解析計画書の事前提出はありませんでした。 - 選択基準の問題(p.84 ”FHAD Selection Criteria Issues”)
KS-50039 試験の申請時にはFHADから選択された64例のデータが提出されました。STORM 試験の患者集団と KS-50039 試験の患者集団の選択除外基準を比較すると、大きな違いがあり、選択バイアス、対象疾患の誤分類、および交絡がある可能性が高いと指摘されました。(例:STROM試験は余命4ヶ月未満の患者は除外されているが、KS-50039 試験では余命に関する除外基準は設定していない) - 評価日の問題(p.87 “Index Date Issues”)
STORM試験とKS-50039 試験における生存期間のindex dateはいずれも直近の治療に失敗した時点と定義しています。しかし、STORM試験ではすべての患者が治験治療を受けている一方で、FHADで選択された患者は64例中27例で後治療が行われていませんでした。これにより、FHADでは早期にイベント発生により打ち切りになった患者が含まれており、生存期間の推定にバイアスが生じている可能性が指摘されました。これを受けて、申請者はindex dateを変更した感度分析の結果を提出しています。 - 同等性の問題(p.89 “Comparability Issues”)
STORM 試験に登録された患者は、全員が治験治療を受けるのに十分な生存期間が見込まれていたのに対し、KS-50039 試験では後治療を受けられないほど予後が悪い患者が含まれています。実際、STORM 試験の患者集団とKS-50039 試験の患者集団の間には、ベースラインの特性に不均衡がありました。例えば、KS-50039 試験のコホートでは、過去の治療歴が異なり、ECOG Performance Statusやデータ欠損の分布も異なっていました。治療群間の不均衡は、研究計画や解析の段階で十分に説明されていなかったため、両試験を比較することは困難であるとFDAは指摘しています。
FDAはこれらの問題点を解消するための再解析を求めましたが(p.91 “Additional Analyses ”)、STORM試験の比較対照としては不十分と結論づけられています。
最後に
今回はデータベース研究計画に対するFDAのRecommendationについて、Reviewの探し方やReviewの一部を紹介しました。
このようなReviewには、さらに詳細なFDAのコメントが書かれていますので、是非ともご興味のある医薬品で検索・閲覧をしてみてください。
引用
- 日本製薬工業協会 医薬品評価委員会 データサイエンス部会 2015年度タスクフォース3 「Real World Dataの活用」Ver1.1 2015年 11月 https://www.jpma.or.jp/information/evaluation/results/allotment/lofurc0000007olq-att/rwd.pdf
- 日本製薬工業協会 医薬品評価委員会 医薬品評価委員会 臨床評価部会 タスクフォース2 「リアルワールデータを承認申請へ~活用促進のための提言~」2020年 4月
https://www.jpma.or.jp/information/evaluation/results/allotment/lofurc0000005k34-att/bd_rwd_sg2.pdf


