はじめに
近年、医療業界においてもリアルワールドデータ(RWD)の活用が進み、データベースを用いた研究(DB研究)が様々報告されています。
一方で、企業でこうした研究を行う際には、社会的意義に加えて企業の利益という視点がどうしても必要になります。つまりDB研究によって、なんらかの経済的な価値を生み出すことを考えなければならないということです。
RWDを用いたDB研究の成果を企業の経済価値につなげるためには、DB研究で生み出せる価値について理解した上で、企画段階から、目標とする経済価値に焦点を当てて構想を練る必要があります。
本記事では、DB研究によってどのような価値を得られるかについて、具体例を交えて紹介します。本記事の内容が、DB研究の企画を立てる際の参考になればと思います。
DB研究で生み出せる価値の分類
DB研究で生み出せる価値は多岐に渡ります。本記事ではその中でも特に重要となる以下の3つのトピックに関して、それぞれ紹介します。
なお、少し視点を変えた分類や、より包括的な分類もありますので、是非参考文献をご確認ください1), 2)。
- PoCとしての役割
- 治験データの代替
- エビデンスの補填
PoCとしての役割
主に研究初期のステージにおいて、DB研究は主にProof of Concept(PoC)としての役割を担います。仮説の妥当性をDB研究で確認することで、研究の成功確率を高める、仮説検証のサイクルを加速するという価値を生み出します。
以下に、抗精神病薬の多剤大量投与に関する研究事例を紹介します。
抗精神病薬多剤投与の是正研究
2010年ごろ、抗精神病薬の多剤大量投与が問題として取り上げられました。諸外国と比較して日本での薬剤投与数が明らかに多く、そうした実態は不用意に副作用リスクを高め、無駄なコストを発生させているのではないかというものです。この問題提起の初期の根拠データは、特定の医療機関における調査データやアンケート調査によるものであり、言うなれば仮説の段階です。
上記背景のもと、「抗精神病薬の多剤大量投与の安全で効果的な是正に関する臨床研究」が開始されました3)。
研究開始時点での仮説を要約すると以下の2つになります
- 日本全体で抗精神病薬は多剤・大量に処方されているかもしれない
- 抗精神病薬の処方数を減らすことで、副作用の軽減や医療費削減といったメリットが得られるかもしれない
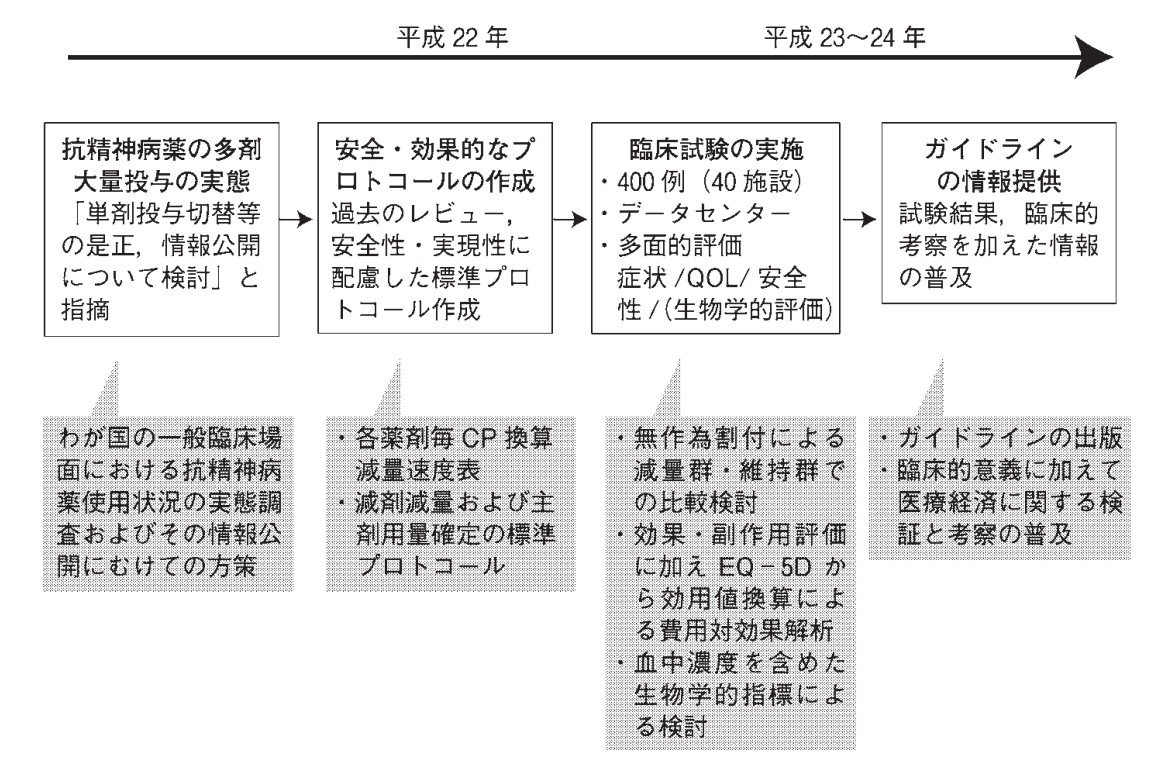
この仮説の検証は下図に示すフローで進められました3)。
注目したいのは臨床試験に先立って実施された実態調査です。日本全体での抗精神病薬の投与状況を、DB研究によって確認し、多剤投与の実態が確かに存在することを明らかにしています4).
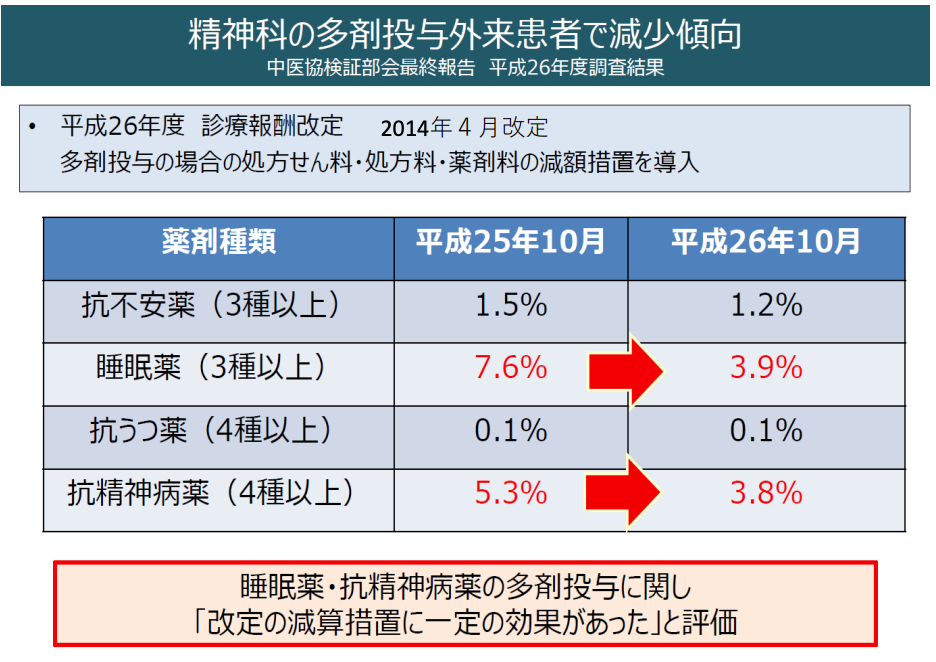
DB研究によるPoCの後、減剤に関する臨床研究も行われ、これらの研究結果も踏まえて、最終的には診療報酬が改定されました。具体的には抗精神病薬や抗不安薬の多剤投与時に診療報酬を減算する制度が追加され、国内の抗精神病薬の多剤投与抑制に大きく貢献したと考えられています5)。
上述した例は、企業の創薬研究とはやや内容が異なるものですが、研究初期の仮説をDB研究で検証するというアプローチ自体は、創薬研究にも応用できる汎用的な手法ではないでしょうか。
治験データの代替
RWD・DB研究において、治験データの代替は特に価値が大きく、そして実現が難しいトピックです。
仮に、治験の一部がDB研究で代替できれば、必要な患者数が減り、期間短縮も狙えます。これによるコスト効果は非常に大きなものとなります。
しかし、残念ながら日本国内ではDB研究の結果を、治験の代替として直接申請に利用することは現状できません。申請に耐えうる品質のDBがないことと、制度が整っていないことが主たる要因です。(なお、海外では様々な事例があります)
ただし、このような状況ではあるものの、法整備も徐々に進みつつあり、申請にDB研究の結果を活用する動き自体は国内でもみられます。日本国内の現状を把握できる事例として、エヌトレクチニブの適応拡大(中外製薬)を以下に紹介します。
エヌトレクチニブの適応拡大申請
中外製薬はエヌトレクチニブの適応拡大(ROS1 融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌)申請でDB研究の結果を参考資料として提出しました6)。
申請の概略としては以下です。
- 非小細胞肺がんの1~2%がROS1融合遺伝子陽性であり、患者数が少ない
- 同適応の薬剤としてクリゾチニブがあり、本剤は2剤目
- 国際共同第2相臨床試験(STARTRK-2試験)および海外で実施した3つの第1相臨床試験の統合解析結果に基づいての申請
- 有効性評価は、ROS1融合遺伝子陽性の非小細胞肺がんの患者53名を対象として行い、安全性評価は4つの試験に登録された355名で実施
- 患者数の少なさから、クリゾチニブとの比較試験は実施困難とし、非介入試験(WO40977 試験)で両剤の比較を行った
上記の中の、WO40977試験が、RocheグループのFlatiron HealthのDBを用いた解析結果であり、クリゾチ二ブとの臨床的位置付けを説明するための参考資料としての位置付けで報告されています。
医薬品医療機器総合機構の回答
結果としては、残念ながら治験データの代替として完全には受け入れられてはいません。機構はWO40977 試験を用いて両剤の臨床的位置付けを説明することには限界がある旨を以下のように回答しています(抜粋)6)。
WO40977 試験の結果に基づいて本薬とクリゾチニブとの臨床的位置付けを説明することは、下記の理由等から限界がある。
- WO40977 試験は外部比較による非介入研究であり、患者背景因子の偏りが結果解釈に影響を及ぼす 可能性があること。 ECOG PS 等、NSCLC の予後因子として重要であることが報告されている(Am J Clin Oncol 1993; 16: 301-9)にもかかわらず、Flatiron Health Analytic Database に登録された患者の大半で当該因子に関する情報が欠測しており、傾向スコアの調整に用いることができない因子が存在することから、 WO40977 試験における傾向スコアの調整には限界があると考えること。
- ROS1 融合遺伝子陽性の切除不能な進行・再発の NSCLC 患者における真のエンドポイントであるOS と TTD との関連は明らかでなく、また、TTD が延長することの臨床的意義は不明であること。
- さらに、TTD を評価項目として本薬とクリゾチニブの有効性を比較することについて、治療中止の正確な理由や時期が不明である場合があること、TTD の定義が群間で異なるため比較可能性が担保 されていないこと等の理由から、限界があると考えること。
機構の回答から、日本国内でDB研究を治験データの代替として利用するには、まだまだハードルがあることがわかりますが、一方で具体的な課題が見えてきたとも言えます。上記のような課題をクリアしていくことで、治験データの代替としての価値がより現実的なものになっていくでしょう。
なお、関連のあるトピックとして「製造販売後調査へのDB活用」があげられます。つまり治験ではなく、製造販売後調査の一部をDB研究で代替するものです。こちらについては法整備も進んでおり、事例が多数存在します。詳しくは過去記事をご覧ください。
エビデンスの補填
たとえ臨床試験を実施していたとしても、その結果だけでは、薬を使う側(医師、患者)にとって完全な安心材料にならないことがあります。
このような場合にDB研究の結果をエビデンスの補填とすることで、薬の利用を促進できる可能性があります。
以下にバイオシミラーでの例を紹介します。
バイオシミラーの有効性・安全性研究
バイオシミラーはバイオ医薬品の後発品ですが、低分子医薬品の後発品(ジェネリック医薬品)と比べて切り替えが進んでいません。その背景には保険制度を含めた様々な要因があると言われていますが、「エビデンス不足による有効性や安全性への不安」は大きな要因の一つです7), 8)。
このような状況において、先発品との同等性をRWDを用いたDB研究で検証し、エビデンスの補填とすることは1つの選択肢になります。
具体例として、インフリキシマブおよびそのバイオシミラーであるCPT-13を比較し、有効性・安全性についてその同等性を示した研究があります。
フランス、イギリスの保険機関からそれぞれ同様の研究結果が報告されており9), 10)、バイオシミラー利用促進の一助になっていると考えられます。
すでに臨床試験で確認されている内容を繰り返し示す研究ではありますが、臨床現場に残る不安感を取り除き、薬の利用を促進させられるという意味では、製品価値の向上に寄与していると言えるでしょう。
最後に
DB研究によってどのような価値を得られるか?というテーマについて、いくつかの例を紹介しました。
DB研究をうまく企業の経済価値に繋げることができれば、次のDB研究への投資も可能となります。大変難しいテーマではありますが、DB研究を企画する際には、その研究で生み出す企業の価値について一考していただければと思います。
関連記事
引用
- Vivek A. Rudrapatna, etal. Opportunities and challenges in using real-world data for health care J Clin Invest. 2020;130(2):565-574 https://doi.org/10.1172/JCI129197
- 中外製薬 デジタル戦略説明会資料 59p https://www.chugai-pharm.co.jp/cont_file_dl.php?f=FILE_1_107.pdf&src=%5B%250%5D,%5B%251%5D&rep=117,107
- 精神経誌(2012)114巻6号 抗精神病薬の多剤大量処方はどう認識されているかhttps://journal.jspn.or.jp/jspn/openpdf/1140060683.pdf
- 奥村泰之,野田寿恵,伊藤弘人: 日本全国の統合失調症患者への抗精神病薬の処方パターン: ナショナルデータベースの活用. 臨床精神薬理 16(8): 1201-1215, 2013.
https://jglobal.jst.go.jp/detail?JGLOBAL_ID=201302242233024358 - リアルワールドデータの活用事例 56p http://masaki.muto.net/lecture/202010141.pdf
- エヌトレクチニブの審査報告書 https://www.pmda.go.jp/drugs/2020/P20200225007/450045000_30100AMX00015_A100_1.pdf
- バイオシミラー学会のアンケート調査結果 http://www.ge-academy.org/img/ge_anq201805.pdf
- バイオシミラーに関する調査(患者アンケート) https://insight.rakuten.co.jp/report/medical/20200327/
- Meyer A, etal. Effectiveness and safety of reference infliximab and biosimilar in Crohn disease: a French equivalence study. Ann Intern Med. 2019;170(2):99–107. https://pubmed.ncbi.nlm.nih.gov/30534946/
- De Cock D, etal. early real world data from the british society for rheumatology biologics registers for rheumatoid arthritis. Ann Rheum Dis. 2017;76:555–556. https://www.semanticscholar.org/paper/FRI0196%E2%80%85Biosimilars-in-the-uk%3A-early-real-world-the-Cock-Watson/5cb56225ebca76b56fdc9677e8dc4542b934256e#paper-header