はじめに
リアルワールドデータを用いた観察研究では、多くの複雑な研究デザインが多数存在し、解析で取り扱う変数の数も多いです。そのため、研究計画立案や生み出されたエビデンス(RWE)を活用する場面において、曖昧さや誤解につながるリスクがあります。
この課題を解決するために、RECORD声明やRECORD-PE 声明、ISPE-ISPOR 報告ガイドラインといった様々なガイドラインやチェックリストが作成・公開されてきました。
そのような背景で、薬剤疫学研究の透明性・再生性などの課題を解決することを目的として、STaRT-RWE(Structured template and reporting tool for real world
evidence)という薬剤疫学研究のプランニング及びレポーティングツールが開発されました。これは、薬剤疫学研究の研究計画立案時に利用できる構造化されたテンプレートです。本ツールを使うことで、レビュアーや読者、当局等の研究者同士での理解、コミュニケーションを行いやすくなります。
今回紹介する論文(STaRT-RWE: structured template for planning and reporting on the implementation of real world evidence studies1))の筆頭著者はハーバード大学研究者です。本研究はISPE(International Society for Pharmacoepidemiology)やISPOR(International Society for Pharmacoeconomics and Outcomes Research)と協働しています。また日本からPMDAの方も著者に名を連ねており、各国当局のニーズ・関心が強いことが伺えます。
本記事では、STaRT-RWEが開発された経緯や内容を解説します。
リアルワールドエビデンスが抱える課題
リアルワールドデータを用いた研究は、治験や介入研究に比べると、変数の取り扱いやバイアスへの対処の関係で、多様な研究デザイン・解析手法が存在します。そのため、研究計画を立案し、研究を実行し、その成果であるエビデンスを活用する各過程において、下記のような問題が発生します。
- 研究デザインや解析手法の選択
- リアルワールドデータは研究目的に収集されたデータではありません。そのようなデータを用いて高いレベルのエビデンスを創出するには、時間軸の取り扱い・交絡やバイアスへの対処・多くの変数の取り扱いに注意が必要です。そのため、多様で複雑な研究デザイン、解析手法を適切に選択する必要があり、そこに難しさや曖昧さがあります。
- 研究のreproducibility(再生性)
- ある研究の論文を読んだ他者が、同じデータセットを使って同じ結果を再生できることが望ましいです。しかしデータベース研究では報告様式や解析手法の詳細が明快ではなく、reproducibilityに問題を抱えていることが多いです。
- プランニングやエビデンス活用時の曖昧さや誤解
- 様々なガイドラインやチェックリストが存在しますが、それでも曖昧さを排除しきれません。そのためエビデンスの活用をするときに、誤った解釈をしてしまうリスクがあります。
上述した課題に関連してリアルワールドデータのメリット・デメリットについては、以前の記事「リアルワールドデータでできること・できないことのまとめ」をご覧ください。
リアルワールドエビデンスの理想的な状態
先述した課題を解決するためには、transparency(透明性)とreproducibility(再生性)を高めることが大切です2)。そのことによって、次のようなメリットが生まれます。
- 同じResearch Questionについて複数の研究結果、異なるデータベースを用いた研究結果のエビデンスを統合して解釈しやすくなる
- レビュアーが各研究結果を評価しやすくなる
- 特に当局では特に高い透明性の研究が求められている。また提供されたデータセットに対して、結果を再生できることが望ましい。
こういったメリットを享受することで、リアルワールドエビデンスの価値が高まり、社会での活用も進んでいくことが期待されます。
STaRT-RWEを開発した目的
STaRT−RWEを開発した目的は、
- RWEのメソッドについて透明性が高く明確なコミュニケーションができること
- レビュアーが各研究の骨子を素早く理解し、重要な情報を取得・理解できること
- reproducibilityを高め、結果の妥当性を検証し、エビデンスを統合できること
です。
このツールは薬剤疫学において、
- effecitiveness(有効性)
- safety(安全性)
に関する研究に特にフォーカスして使われました。
その他には、
- exploratory(探索)
- descriptive(記述)
- prediction(予測)
に関する研究にも活用できます。
STaRT-RWEのテンプレート構成
STaRT-RWEテンプレートは下記項目で構成されています。
- 管理情報
- バージョン履歴
- 研究デザインダイアグラム
- データソース及びソフトウェア情報
- インデックス日の定義
- 適格基準
- 除外基準
- 共変量
- アウトカム
- フォローアップ
- 解析仕様
- 感度分析
- 患者フローダイアグラム
- 検出力・サンプルサイズ計算
- 用語集
- 略語
STaRT-RWE libraryの研究例
STaRT-RWEの各テンプレートを紹介する前に、筆者が用意した具体的な活用方法(研究例)を紹介します。
- プロペンシティスコアマッチングを用いたeffectivenessを比較するコホート研究
- エンパグリフロジンとDPP-4阻害薬の主要心血管イベント比較(new-user, active comparator cohort study)
- 電子カルテデータを用いたアウトカム予測モデル
- 心不全患者のEF予測
- 妊娠中の薬剤の安全性
- 妊娠中のトピラマート曝露後の口唇口蓋裂発生リスクの評価
- コホート研究の代替デザイン
- MMRワクチンにおける痙攣のリスク評価(Self-controlled study design)
もっと具体的に知りたい方は、Manuscript: STaRT-RWE: A structured template for planning and reporting on the implementation of real-world evidence studiesをご覧ください。
各テンプレート解説
研究デザインダイアグラム
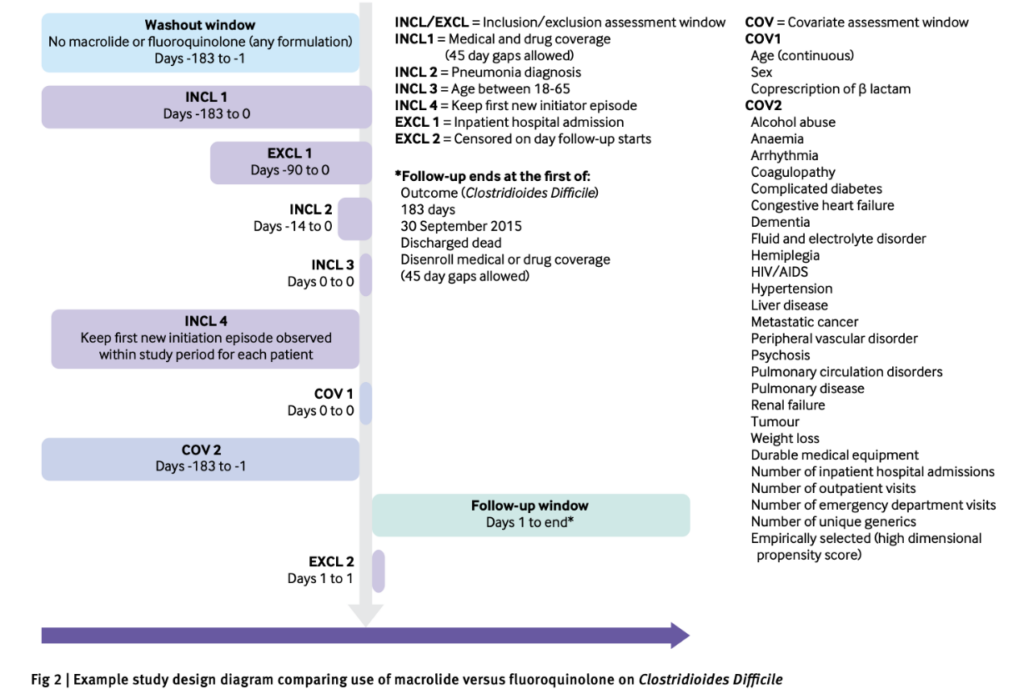
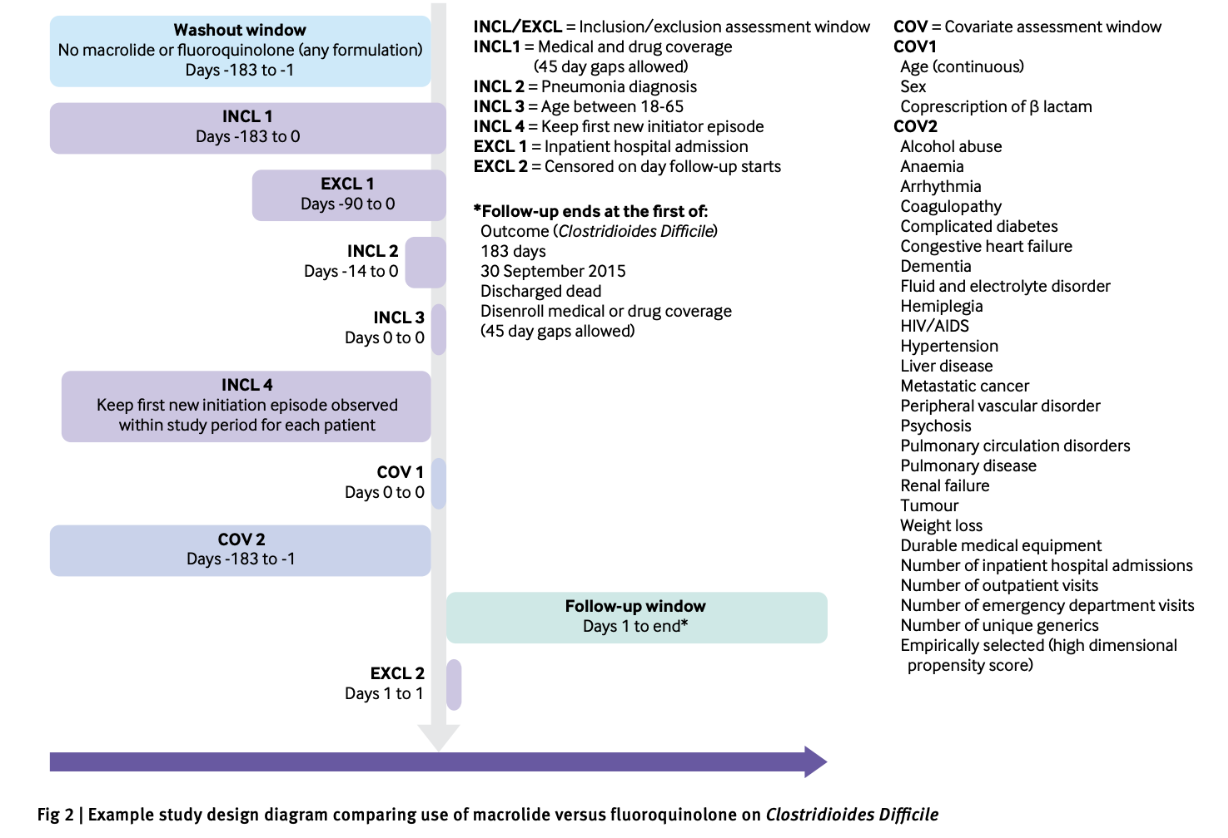
図1: 研究デザインダイアグラム。記載している例はClostridioides Difficileに対するマクロライドとフルオロキノロンの比較(引用1)Fig 2より引用)
研究デザインダイアグラムは、解析コホートをつくるための
- インデックス日/加入期間/追跡期間
- 適格/除外基準
- 曝露・アウトカムの測定期間/ウォッシュアウト期間
- 共変量の測定期間
などを記載したサマリーです。
適格/除外基準

図2: 適格基準(引用1)appendix1 TABLE3より引用)

図3: 除外基準(引用1)appendix1 TABLE3より引用)
適格/除外基準はそれぞれ複数条件あることが多いので、条件ごとに詳細を記載します。特に条件ごとの抽出方法(用いるコードやアルゴリズム)や判定期間の記載が大切です。各条件のバリデーションに関する記載箇所も用意してあります。
アウトカム

図4: アウトカム(引用1)appendix1 TABLE3より引用)
アウトカムに対しても、条件ごとの抽出方法(用いるコードやアルゴリズム)やフォロー期間の記載が大切です。
フォローアップ期間設定
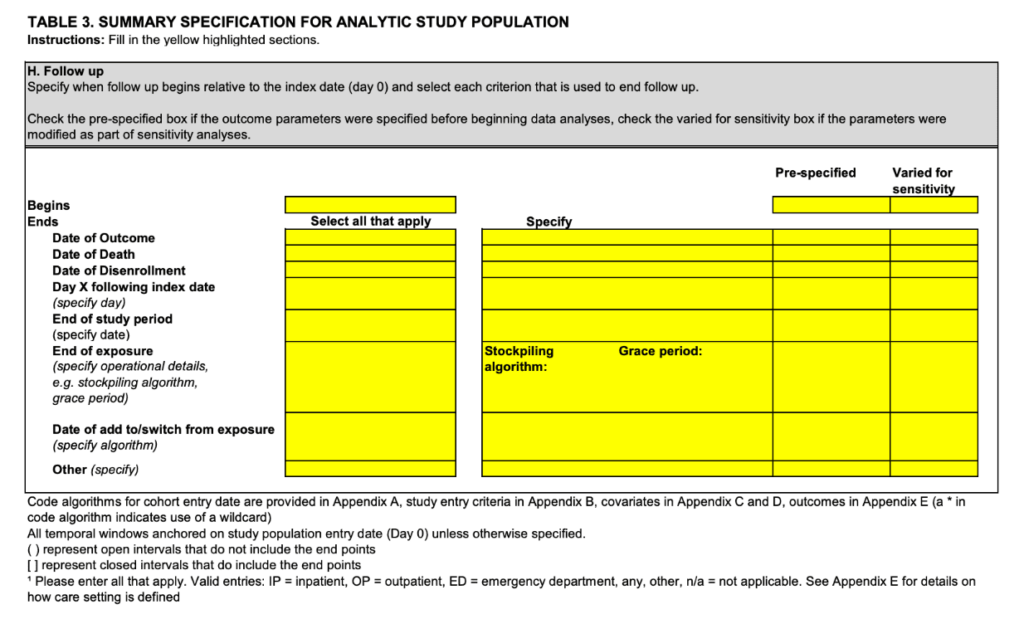
図5: 期間設定(引用1)appendix1 TABLE3より引用)
データベース研究では時間軸の取り扱いが大切です。フォローアップ期間の終了日については、
- アウトカム発生日
- 死亡日
- データ上の最終確認日/離脱日
- 研究期間終了日
など複数の候補/組み合わせがあり得るので、それぞれ記載します。
感度分析

図6:感度分析(引用1)appendix1 TABLE3より引用)
感度分析のテンプレートには、条件ごとに
- 変更する変数
- その理由
- 主解析と比べて、その感度分析で何を知りたいのか
ということを記載します。
最後に
薬剤疫学研究のプランニング及びレポーティングを支援する構造化されたテンプレートとして、STaRT-RWEを紹介しました。基本的にはデータベース研究、薬剤疫学研究についてのガイドラインやチェックリストを踏襲しています。しかし、より構造化されており、レビュアーや読者、当局等の研究者同士での理解、コミュニケーションを行いやすくなっています。テンプレートに留まらず今後は、入力データを読み込むと結果が出力されるソフトウェアまで開発されることが期待されます。
※データベース研究の計画立案について、無料でご相談を受け付けております。こちらよりお問い合わせください。
引用
- Wang SV, Pinheiro S, Hua W, Arlett P, Uyama Y, Berlin JA, Bartels DB, Kahler KH, Bessette LG, Schneeweiss S. STaRT-RWE: structured template for planning and reporting on the implementation of real world evidence studies. BMJ. 2021 Jan 12;372:m4856.
https://pubmed.ncbi.nlm.nih.gov/33436424/ - Wang SV, Verpillat P, Rassen JA, Patrick A, Garry EM, Bartels DB. Transparency and Reproducibility of Observational Cohort Studies Using Large Healthcare Databases. Clin Pharmacol Ther. 2016 Mar;99(3):325-32.
https://pubmed.ncbi.nlm.nih.gov/26690726/