はじめに
ヘルシンキ宣言をはじめとし、人を対象とする医学研究を行うには倫理原則を遵守しなければなりません。では、近年盛んになってきたリアルワールドデータ(RWD)を用いた研究ではどのような研究倫理を守るべきなのでしょうか。
関連する指針や法律等を見ながら、研究倫理についてどのように書かれているのかを紹介します。RWDを用いた臨床研究をする際の参考にしてください。
※ 記事執筆時点での情報を元に作成しています。実際に研究をする際は、最新の情報を必ずご確認ください。
臨床研究の分類:RWDを用いた臨床研究の立ち位置について
日本における臨床研究は、遵守すべき規制ごとに分類することで、体系的に整理できます。1)
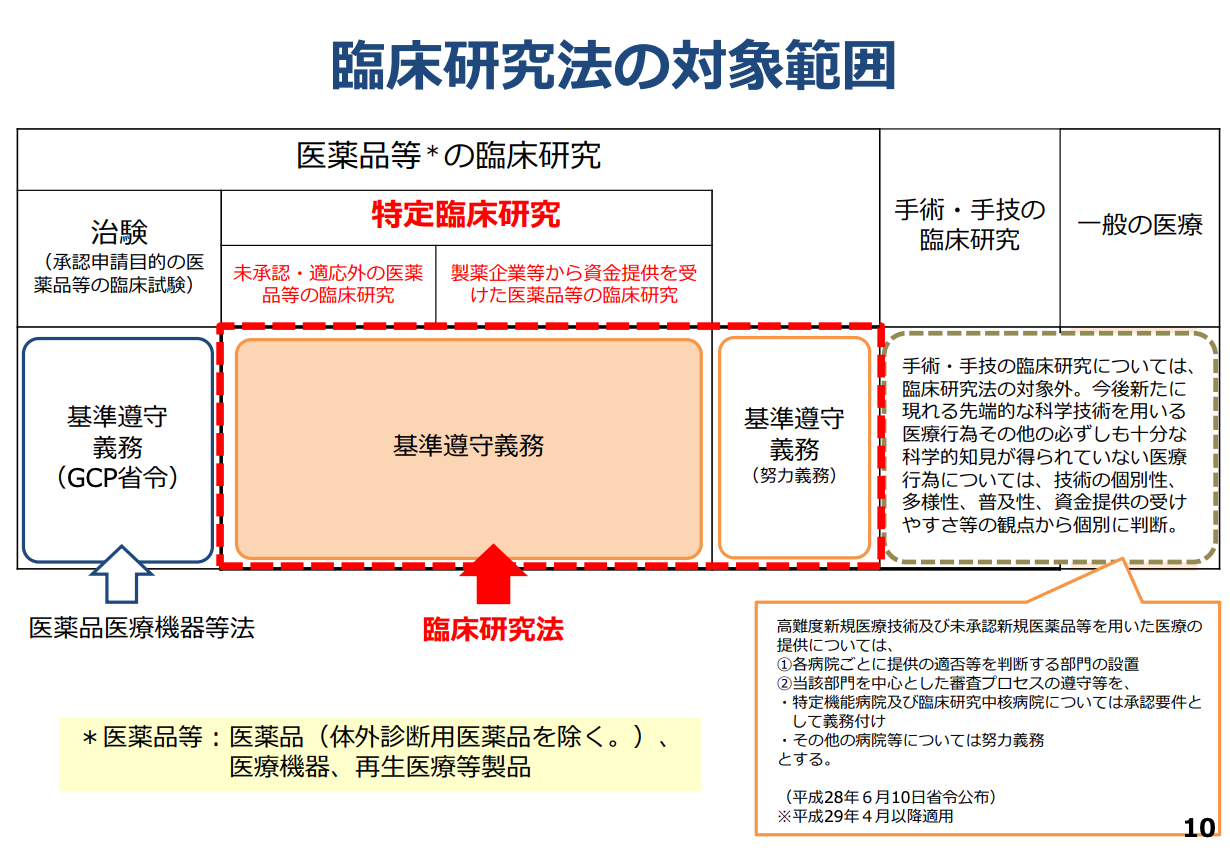
<法律の遵守が必要な臨床研究:図1>
- 治験:「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 (薬機法)」または「再生医療等の安全性の確保等に関する法律」に基づき医薬品、医療機器、再生医療等製品の承認申請に添付する資料として、有効性や安全性などを確認するための臨床試験を指します。
- 特定臨床研究:2018年4月1日より施行された臨床研究法の遵守が義務づけられるものは「特定臨床研究」と定められています。特定臨床研究の範囲については、以下のように定義付けられています。
- 薬機法における未承認・適応外の医薬品等の臨床研究(GCP遵守の治験、製造販売後臨床試験を除く)
- 製薬企業等から資金提供を受けて実施される当該製薬企業等の医薬品等の臨床研究(観察研究を除く)
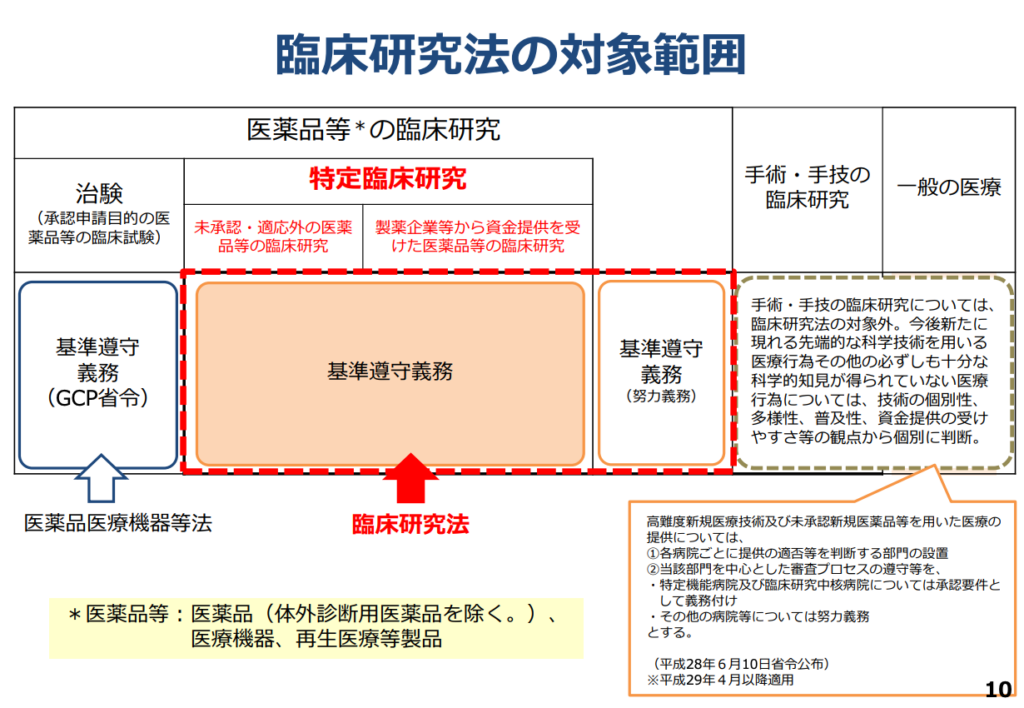
図1:厚生労働省「臨床研究法の概要」令和2年7月7日より引用
<法律の遵守が必要ない臨床研究>
治験、特定臨床研究以外の臨床研究は 「人を対象とする医学系研究に関する倫理指針」を遵守することが原則となっています。また、遺伝子治療等臨床研究やヒト受精胚の作成を行う生殖補助医療研究などは「人を対象とする医学系研究に関する倫理指針」に規定されていない事項もあるので、分野ごとの指針も確認することに留意しなければなりません。
これらを踏まえると、観察研究であるRWDを用いた臨床研究は、法律の遵守が必要ない臨床研究に該当し、「人を対象とする医学系研究に関する倫理指針」を遵守しなければならないことがわかります。
※ 観察研究(研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は試料を利用する研究)が特定臨床研究に該当しないということについては、厚生労働省のQ&A集「問 1-11」や特定臨床研究の該当性に関するチェックリストのNo.4 に明記されています。
倫理指針におけるRWD研究の立ち位置
人を対象とする生命科学・医学系研究に関する倫理指針(本文、ガイダンス)の「適用範囲」には以下のように書かれています。
<適用される研究>
この指針は、我が国の研究機関により実施され、又は日本国内において実施される人を対象とする生命科学・医学系研究を対象とする。ただし、他の指針の適用範囲に含まれる研究にあっては、当該指針に規定されていない事項についてはこの指針の規定により行うものとする。 また、次に掲げるいずれかに該当する研究は、この指針(既に作成されている匿名加工情報又は非識別加工情報(個人情報保護法に規定する大学その他の学術研究を目的 とする機関若しくは団体又はそれらに属する者により学術研究の用に供する目的で用 いられるものに限る。)のみを用いる研究にあっては、第21を除く。)の対象としない。
ア 法令の規定により実施される研究
イ 法令の定める基準の適用範囲に含まれる研究
ウ 試料・情報のうち、次に掲げるもののみを用いる研究
① 既に学術的な価値が定まり、研究用として広く利用され、かつ、一般に入手可能な試料・情報
② 既に匿名化されている情報(特定の個人を識別することができないものであっ て、対応表が作成されていないものに限る。)
③ 既に作成されている匿名加工情報又は非識別加工情報
すなわち、RWDのうち、既に作成されている匿名加工情報又は非識別加工情報に該当するデータは、研究倫理指針の適用が除外されます。そのため、倫理審査委員会の承認が不要です。レセプト情報・特定健診等情報データベース(NDB)、株式会社JMDC、メディカル・データ・ビジョン株式会社、リアルワールドデータ株式会社など、日本で利用できるRWDの多くがこれに該当します。
※ 「非識別加工情報」とは
行政機関等が保有する個人情報について、特定の個人を識別することができないように個人情報を加工し、当該個人情報を復元できないようにした情報。
※「匿名加工情報」とは
次の各号に掲げる個人情報の区分に応じて当該各号に定める措置を講じて特定の個人を識別することができないように個人情報を加工して得られる個人に関する情報であって、当該個人情報を復元することができないようにしたものをいう。
- 第一項第一号に該当する個人情報:当該個人情報に含まれる記述等の一部を削除すること(当該一部の記述等を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む。)。
- 第一項第二号に該当する個人情報:当該個人情報に含まれる個人識別符号の全部を削除すること(当該個人識別符号を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む。)。
※「匿名加工医療情報」とは
医療分野の研究開発に資するための匿名加工医療情報に関する法律(次世代医療基盤法)第2条(第3項)より抜粋
次の各号に掲げる医療情報の区分に応じて当該各号に定める措置を講じて特定の個人を識別することができないように医療情報を加工して得られる個人に関する情報であって、当該医療情報を復元することができないようにしたものをいう。
- 第一項第一号に該当する医療情報:当該医療情報に含まれる記述等の一部を削除すること(当該一部の記述等を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む。)。
- 第一項第二号に該当する医療情報:当該医療情報に含まれる個人識別符号の全部を削除すること(当該個人識別符号を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む。)。
一方で、匿名化されていない医療情報を扱う場合において、匿名加工医療情報作成の認定事業者を介さずに、独自の研究班内等で匿名化をし、そのデータを臨床研究に使用する場合は倫理審査委員会での審査が必要となります。(図2の<参考>)
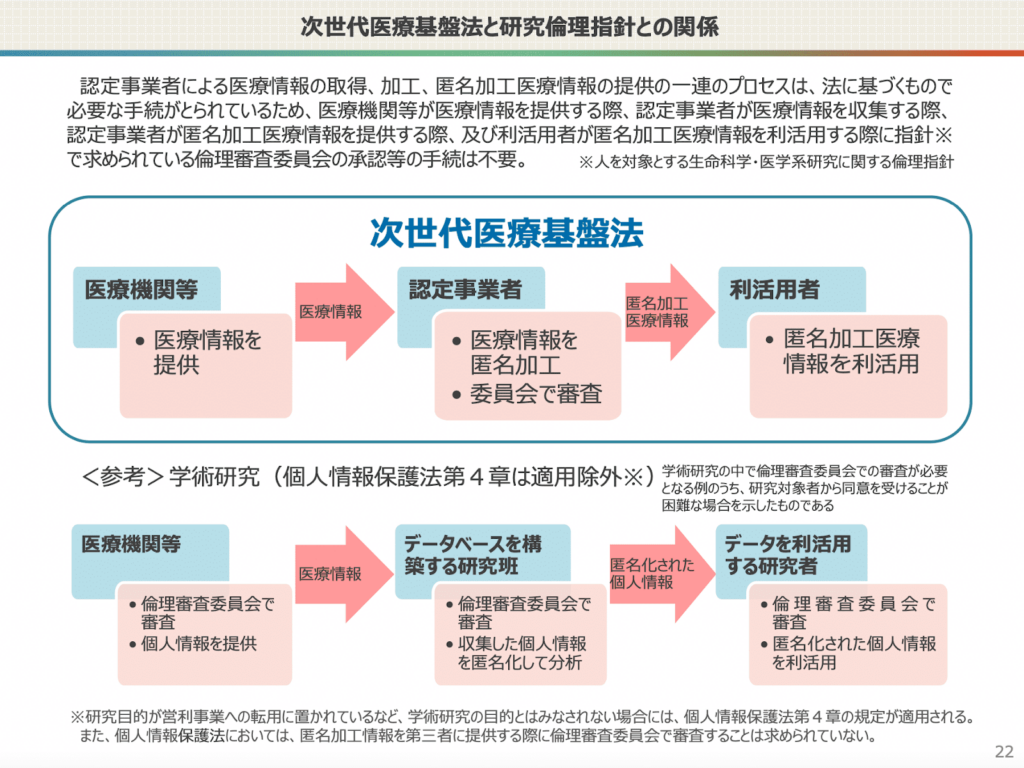
図2:「次世代医療基盤法」とは, 内閣府健康・医療戦略推進事務局, 2021年9月より引用
遵守すべき事項
先述の通り、RWDのうち、既に作成されている匿名加工情報又は非識別加工情報に該当するデータは、研究倫理指針の適用が除外されます。しかし、人を対象とする生命科学・医学系研究に関する倫理指針(ガイダンス)の「適用範囲」には”第21を除く”と書かれていました。つまり、既に作成されている匿名加工情報又は非識別加工情報に該当するデータを扱う場合にも、第21 に書かれている「匿名加工情報の取扱い」は適用されるということになります。
あえて倫理指針で匿名加工情報の取扱いについて書かれているのはなぜでしょう?個人情報保護法にはその取り扱いについて書かれていないのかという疑問が出てきます。
実は、個人情報保護法の第76条 第1項第3号「適用除外」では、個人情報取扱事業者等がその個人情報等を学術研究に用いる場合には、同法 第4章の規定は適用されないとしています。
この第4章には「個人情報取扱事業者の義務等」が書かれており、匿名加工情報の作成や提供、安全管理措置等についての重要な事項が書かれています。つまり、学術目的であればこれらの事項が適用されないこととなります。
しかしながら、学術目的とはいえ、匿名加工情報の作成や提供等のやりとりが円滑となるようなルールは必要です。そのため、倫理指針では「第21 匿名加工情報の取扱い」において、個人情報保護法 第4章と同様の内容が改めて規定されているのです。
では、倫理指針の「第21 匿名加工情報の取扱い」を見てみましょう。
研究者等が匿名加工情報を作成する際には、個人情報を復元することができないようにするために必要な基準に従い、当該個人情報を加工しなければならないことが書かれています。加えて、加工方法の情報漏えい防止対策や本人を識別するために、当該匿名加工情報を他の情報と照合してはならない等の事項についても書かれています。
匿名加工情報の提供を受けた場合も同様に、個人を特定する行為をしてはいけないことや、受け取った情報の安全管理について書かれています。
- 当該匿名加工情報の作成に用いられた個人情報に係る本人を識別するために、必要な情報を取得したり、他の情報と照合してはならない。
- 当該匿名加工情報の安全管理のために必要かつ適切な措置、匿名加工情報の取扱いに関する苦情の処理その他の匿名加工情報の適正な取扱いを確保するために必要な措置を自ら講じ、かつ、当該措置の内容を公表するよう努めなければならない。
※ 「個人情報取扱事業者とは
この法律において「個人情報取扱事業者」とは、個人情報データベース等を事業の用に供している者をいう。ただし、次に掲げる者を除く。
- 国の機関
- 地方公共団体
- 独立行政法人等
※「学術研究機関等」「学術研究目的」の定義や取扱いについて
以下の資料をご参照ください。
- 個人情報保護委員会 FAQ:『大学等の学術研究機関と民間企業や私立病院等が、学術研究目的の研究を共同で行う場合における個人情報の取扱いに関して留意すべき点を教えてください。』
- 第2回「生命科学・医学系研究等における個人情報の取扱い等に関する合同会議」資料1, 令和3年10月11日, 個人情報保護委員会:スライド11~21
※「個人情報を復元することができないようにするために必要な基準」は以下をご参照ください。
最後に
本記事の要点は以下の通りです。
- 既に作成された匿名加工情報を使用した研究ならば、倫理審査委員会での承認は不要である。
- 個別の研究班内等で収集した個人情報を匿名化し、それを用いて研究をするならば、倫理審査委員会の承認が必要である。
- 個人情報保護法の第76条 第1項第3号「適用除外」に当てはまるような学術目的で匿名加工情報を取り扱う場合は、倫理指針の「第21 匿名加工情報の取扱い」を遵守する。
- 個人情報保護法の第76条 第1項第3号「適用除外」に当てはまらない目的で匿名加工情報を取り扱う場合は、個人情報保護法第4章「個人情報取扱事業者の義務等」を遵守する。
確認すべき指針、関連法律等のまとめ
<遵守すべき倫理指針>
<匿名加工情報の利活用に関する法律等>
<匿名加工医療情報の利活用に関する法律>
<匿名レセプト情報・匿名健診等情報の利活用に関するガイドライン>
- 匿名レセプト情報・匿名特定健診等情報の提供に関するガイドライン, 令和2年10月(令和3年10月改正)
- 厚生労働分野における個人情報の適切な取扱いのためのガイドライン等, 厚生労働省
- 医療情報システムの安全管理に関するガイドライン, 厚生労働省
- 2022.02.7現在では第5.1版(令和3年1月)が最新。
- NDB利用する者はこれに従ったセキュリティ対策が必要。
- 医療情報システムの安全管理に関するガイドライン, 厚生労働省
引用
- 薬剤師が知ってほしい 「臨床研究法 ・ 臨床研究倫理指針」 の基礎知識, アプライド ・ セラピューティクス Vol. 10, pp 2-6, 2018
https://www.jstage.jst.go.jp/article/appliedtherapeutics/10/0/10_2/_pdf/-char/ja