はじめに
RWD研究はRCTにない利点がありますが、様々なバイアスが発生する可能性があります。
それらに適切に対処するには、まずバイアスを十分に理解しなければなりません。
本記事では、データベース研究で重要なバイアスを列挙し、その一部のバイアスを事例ベースでご紹介します。
データベース研究で重要なバイアス
2000年から2018年に出版された二次データベースを用いた薬剤疫学研究におけるバイアスについて解説された117論文をレビューした研究があります。1)
こちらのレビューによると、以下のようなバイアスが分類されました。
| Category/Subcategory | Percentage (%)※2 | 論文数※1 |
| Confounding | 63.2 | 74 |
| Confounding by indication | 32.5 | 38 |
| Time-dependent confounding | 6.0 | 7 |
| Unmeasured/residual confounding | 28.2 | 33 |
| Healthy user/adherer effect | 5.1 | 6 |
| Selection bias | 47.0 | 55 |
| Protopathic bias | 3.4 | 4 |
| Losses to follow-up (informative censoring) | 2.6 | 3 |
| Depletion of susceptibles (prevalent user bias) | 10.3 | 12 |
| Missing data | 17.9 | 21 |
| Measurement bias | 46.2 | 54 |
| Misclassification bias | 43.6 | 51 |
| Misclassification of exposure | 23.9 | 28 |
| Misclassification of outcome | 28.2 | 33 |
| Time-related bias | 30.8 | 36 |
| Immortal time bias | 25.6 | 30 |
| Immeasurable time bias | 3.4 | 4 |
| Time-window bias | 2.6 | 3 |
| Time-lag bias | 0.9 | 1 |
※1. 1つの論文が複数のバイアスについて言及しているので、総計は117以上となっている。
※2. 117論文に対する割合
バイアスのカテゴリーとしては、Confounding(交絡バイアス)が最も多く(63.2%、74/117件)、次いでSelection bias(選択バイアス)(47.0%、55/117件)が多いことがわかりました。
各カテゴリーのうち、最も多かったサブカテゴリーのバイアスは以下の通りです。
| カテゴリー | 最も多かったサブカテゴリー |
| Confounding(交絡バイアス) | Confounding by indication(適応による交絡)(32.5%、38/117件) |
| Selection bias(選択バイアス) | Missing data(データ欠損)(17.9%、21/117件) |
| Measurement bias(測定バイアス) | Misclassification bias(誤分類)(43.6%、51/117件) |
| Time-related bias(時間関連バイアス) | Immortal time bias(不死時間バイアス)(25.6%、36/117件) |
この結果は、どのバイアスがこれまで研究者の間で大きな関心を集めてきたかを示しているといえます。したがって、二次データベースを用いた研究では、これらのバイアスの発生を防ぐために特に考慮すべきであると考えられます。
今回はこの中でも、Prevalent user bias、Immortal time bias、Time-window bias、Confounding by indicationについて紹介をします。
Prevalent user bias(既存処方者バイアス)
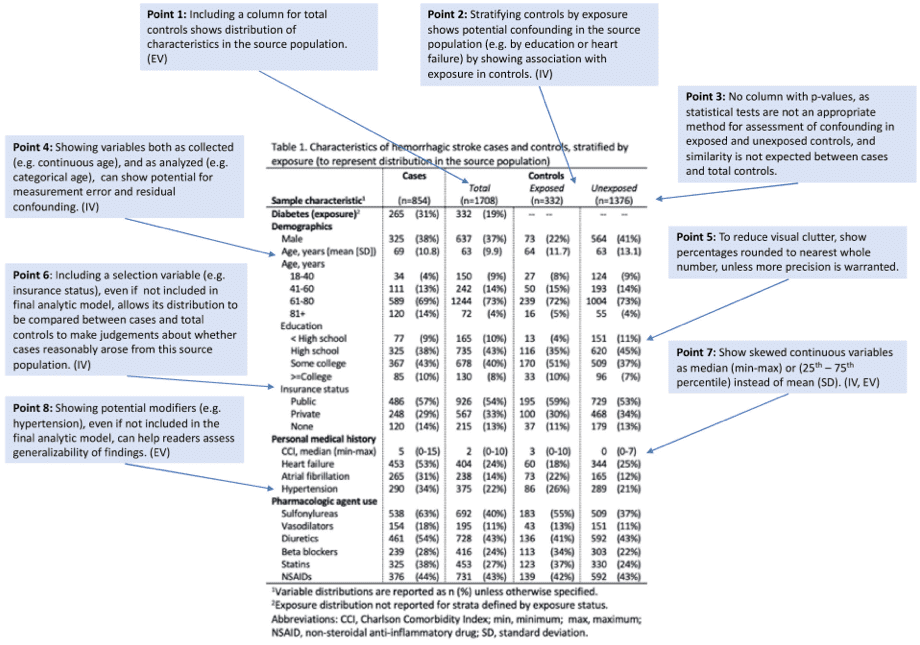
Prevalent user bias(既存処方者バイアス)は、選択バイアスの一つです。追跡開始前からすでに研究対象とする医薬品を使用していた人 (Prevalent user)を 曝露群に含めてしまうことによって引き起こされるバイアスを指します。Prevalent userを対象とする研究では、薬の使用期間が長い人から新たに処方された人までが混在することになります。そのため、薬によるイベントを誘導する期間(Induction period)が異なり、リスク評価に影響を及ぼしてしまいます。
つまり、Prevalent userは、それまで副作用が生じなかったから、薬を飲み続けれられている人です。そのため、曝露群に副作用が起こりにくい人々が選択的に含まれることから、選択バイアスが生じることとなります(副作用の影響を受けやすい人は治療を中断します)。(図1)
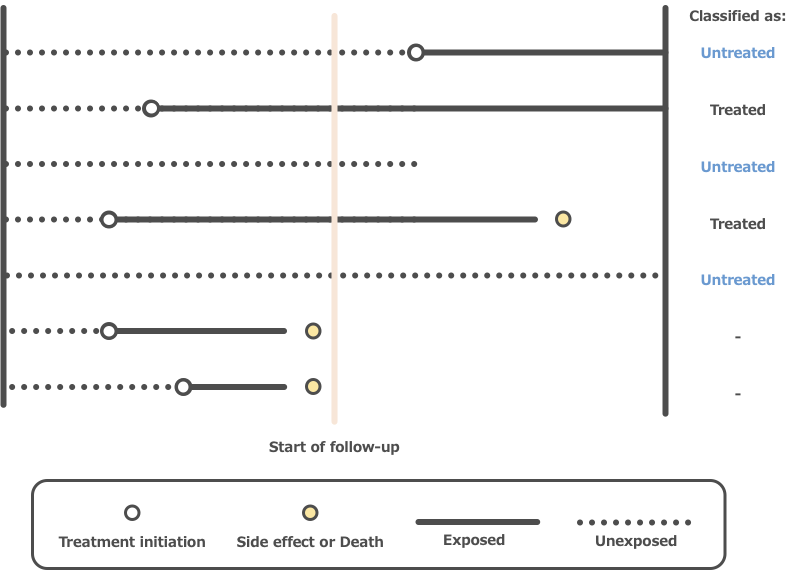
図1. Examples of Prevalent user bias
(引用2を元に作成)
このバイアスの対処方法として、新規使用者のコホート(Inception cohort)に限定するnew user designが挙げられます。
実例:ホルモン補充療法(hormone replacement therapy: HRT)と心血管イベント
1990年代の観察研究では、閉経後にエストロゲンを補充した場合、心血管イベントの発生リスクを減少することが報告されていました。3)しかし、その後いくつかのランダム化比較試験を実施した結果4)-7)、HRTの有益性は否定され、むしろ心血管イベントの発生が上昇することが示唆されました。
この観察研究とランダム化比較臨床試験で結果が食い違った原因の一つとして、Prevalent user biasの可能性が指摘されました。8)
つまり、観察研究の追跡開始前からエストロゲンを使用していた女性が曝露群に多く含まれていたために、曝露群の心血管イベントの発生リスクが本来よりも小さく推定されてしまったということです(それまで副作用が生じなかったから薬を飲み続けられている人が曝露群に入っていた)。
- 補足:ちなみに、もう一つ指摘されている原因はhealthy user effectです。9)詳細は引用論文9を参照ください。
Immortal time bias(不死時間バイアス)
Immortal timeとは、コホートの曝露設定により生じる、研究対象のアウトカムが理論的に起こりえない期間のことをいいます。
例えば、ある薬の曝露群と非曝露群に分けて死亡率の比較をする場合、患者は曝露を受けるまで生存している必要があります(この期間をImmortal time)。
もしも、このImmortal timeを曝露群の追跡期間に誤分類してしまうと、曝露群のアウトカム発現頻度は過小評価されてしまいます(曝露前に死亡したら非曝露群に分類されるので)。結果として、曝露群のほうが非曝露群に比べて本来よりリスクが低く見えてしまいます。これが、Immortal time bias(不死時間バイアス)です。(図2)
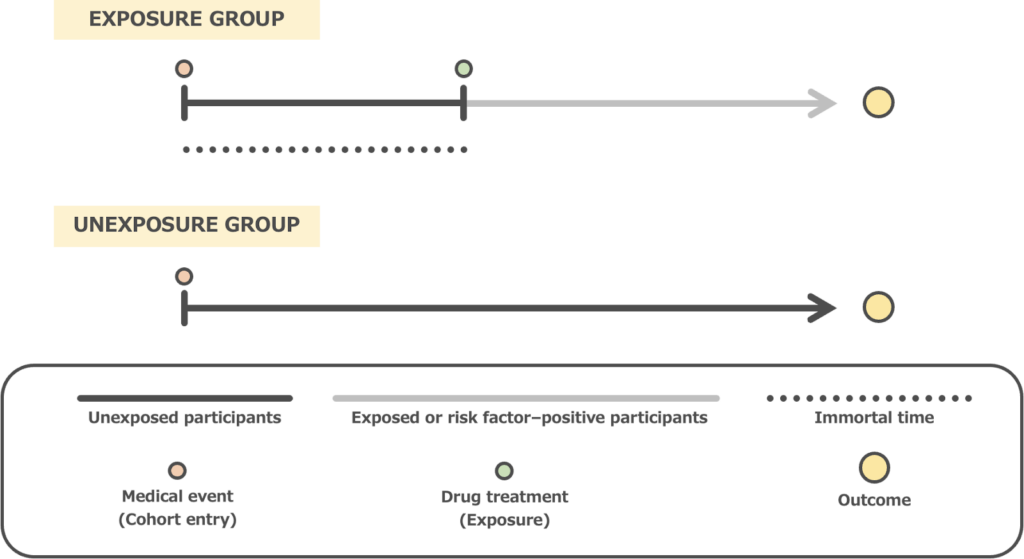
図2. Examples of Immortal Time Intervals
(引用10を元に作成)
対処方法の一部として以下が挙げられます。
- Intention-to-treat解析:曝露群と非曝露群を追跡開始日時点の情報を用いて定義し、その後の曝露状況の変化を無視する方法
- ランドマーク解析:ある一定期間イベントを生じなかった人々の中で曝露と非曝露を定義し、一定期間経過した時点から追跡開始とする方法
実例:吸入ステロイドと死亡
カナダ・オンタリオ州の退院情報データベースを用いたコホート研究が実施されました。11)
- 研究対象者:65歳以上でCOPD加療目的に入院した患者のうち退院した者
- 除外基準:退院30日以内の死亡者
- 曝露:退院後90日以内の吸入ステロイド療法
- アウトカム:退院後1年の死亡 and/or 再入院
- 結果:吸入ステロイド療法を受けた患者は、再入院が24%(95%CI, 22~35%)、死亡が29%(95%CI, 22~35%)少なかった。
この研究の問題点は、退院日を追跡開始日としているにもかかわらず、追跡開始日から90日間の曝露の有無で群分けをしている点です。
曝露群は治療が開始されるまでアウトカムは起きません。つまり、曝露の定義に合致するまで、対象者は”event free”であることが求められます。
この研究のデザインでは、退院31-90日以内の死亡、退院0-90日の再入院が発生する可能性があります。そして、追跡早期にアウトカムが起きた者は、非曝露群に分類されやすくなります。結果として、曝露群は非曝露群に比べて、本来よりも死亡・再入院のリスクが低く見えてしまったのです。
このバイアスを適切に対処した結果、曝露と非曝露群で死亡・再入院の差はないことがわかりました。12)
Time-window bias(曝露判定期間バイアス)
Time-window bias(曝露判定期間バイアス)は、ケース・コントロール研究において、ケースとコントロール群での曝露判定期間が等しくないことにより生じるバイアスです。
例えば、下記のような研究計画を立てたとします。
- ケース群:ケース発現日から過去に遡って曝露の有無を調べる
- コントロール群:観察期間終了時から過去に遡って曝露の有無を調べる
この場合、コントロール群のほうがケース群よりも曝露判定期間が長く、曝露が同定される可能性が高まってしまいます。結果として、曝露がアウトカムを抑制する方向にバイアスを生じることとなります。(図3)
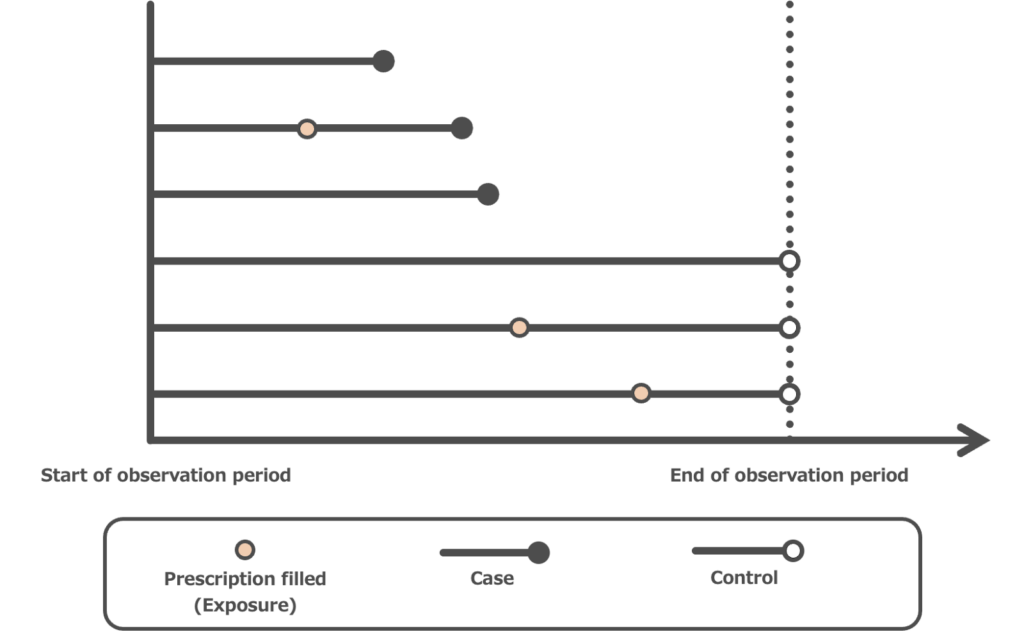
図3. Examples of Time-window bias
このバイアスはケース群とコントロール群間での曝露判定期間を統一することで対処できます。例えば、ケースが発生するたびに、コントロールを人-時間サンプリング(density sampling)に基づいて時点マッチングにより選択し、マッチされた時点から遡って曝露の有無を判断すれば、ケースとコントロールの曝露判定期間は同程度になることが期待できます。
実例:スタチン系と肺がん
スタチン系の薬と肺がんの関係を調査するための、米国退役軍人局のデータベース
を用いたケースコントロール研究が実施されました。13)
- 対象集団:1998年10月〜2004年6月(67ヶ月)に登録されている483,733人
- ケース:肺がんと診断された7280人
- コントロール:残りの476,453人
- 曝露の定義:観察期間中、データ収集完了日までにスタチン系の薬が処方
- ケースの場合:肺がんの診断日以前に処方された場合、曝露と判定
- コントロールの場合:観察期間終了日以前に処方された場合、曝露と判定
- 結果:スタチン使用後、肺がんの発生リスクが45%減少する(調整後オッズ比: 0.55(95%C: 0.52-0.59))
この研究の問題は、ケース群とコントロール群で曝露判定期間が異なる点にあります。
研究の観察期間は67ヵ月間でした。ケース群は過去に遡って曝露を判定するので、曝露判定期間は67カ月未満となります。一方、コントロール群は研究の観察期間である67カ月が曝露判定期間となります。
そして、コントロール群の方がスタチンへの曝露を判定する期間がケース群に比べて圧倒的に長くなり、曝露を同定される可能性が高まります。その結果、本来よりもスタチンの曝露が肺がんの発生を抑制しているかのように見えてしまったのです。
このバイアスを適切に対処した結果、スタチン曝露と肺がんの発生に関連はないことがわかりました。14)
Confounding by indication(適応による交絡)
観察研究では、治療法の割り当ては無作為ではなく、患者の容態など適応を考慮して行われます。
例えば、治療Aと治療Bのどちらが高い治療効果があるかを観察データにて判定する場合、その治療の割り当てには様々な要因が考えられます。
- 患者の背景因子(年齢、性別、併存症、疾患の重症度、他の治療など)
- 治療を受ける医療施設の要因(治療の対象となる疾患の実績が多いなど)
このように患者の背景要因や医療提供者の要因が、治療効果だけでなく治療の割り当てにも影響を与えてしまうことをConfounding by indication(適応による交絡)といいます(図4)
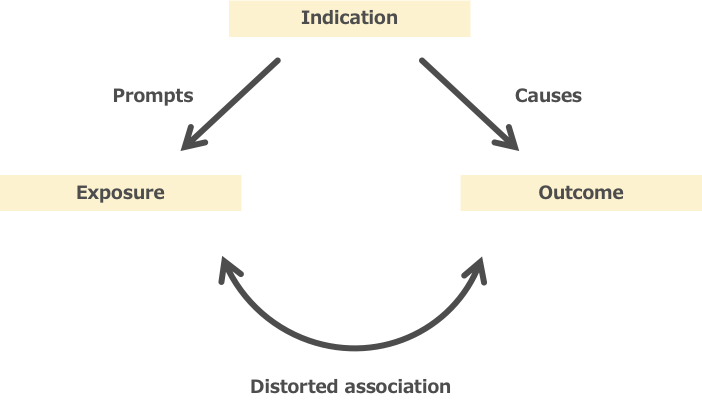
図4. The general principle of confounding by indication
(引用15を元に作成)
対処方法の一つとして、傾向スコア分析(propensity score analysis)が挙げられます。
傾向スコア分析はまず、交絡となり得る要因をなるべく多く計測し、ロジスティック回帰分析などを用いて各患者が特定の治療を受ける確率(=傾向スコア)を予測します。次に治療群と非治療群間のアウトカムを比較する際に傾向スコアでマッチング、調整、層別化、または逆確率による重み付けを行います。これによりConfounding by indicationの影響をある程度まで克服できます。
実例:院内心停止時の気管挿管と重症度
小児の院内心停止時の気管挿管が生存率を改善するかどうかを調査した観察研究が実施されました。16)
- データベース:米国Get With The Guidelines-Resuscitation登録病院のデータ
- 対象集団:2000年1月~2014年12月に院内心停止を起こした18歳未満の小児患者
- 曝露:心停止時の気管挿管
- 主要アウトカム:退院までの生存率
- 結果:気管挿管された患者はされたなかった患者に比べて生存率が低かった
411/1135[36%]対460/1135[41%],RR, 0.89[95%CI, 0.81-0.99]
この研究はConfounding by indicationが複雑になっている可能性が高いと指摘されています。17)患者の心肺蘇生前および心肺蘇生中に存在する臨床状態(例えば、喘息、嚢胞性線維症、上気道閉塞など)は、アウトカムに影響を与えると同時に、気管挿管するか否かの判断にも影響を与えます。つまり、重症度が高く、元々の予後が悪い小児は、挿管される確率が高かったと考えられます。重症度は死亡率の強い予測因子であると同時に、挿管するかどうかの臨床的判断の強い予測因子でもあるため、この影響は特に大きいと言えます。
※ この研究は傾向スコアでマッチングをしていますが、それでも対処しきれていないという指摘です。
最後に
RWDを用いた研究は、膨大なサンプルサイズや一般化可能性が高いことがRCTよりも優れています。しかしながら、その利点を生かすには、データベース研究で問題となるバイアスの種類やそれらが結果にどのように影響を与えるのかを十分理解することが求められます。そして、対処できるのならば適切に対処し、対処できないのならば研究の限界としてそれをきちんと論文に記述しなければなりません。本記事がその参考になればと思っています。
※データベース研究における研究デザインやバイアス・交絡への対処法についてもご相談を受け付けています。お問い合わせフォームよりお気軽にご連絡ください。
引用
- Prada-Ramallal, G., Takkouche, B. & Figueiras, A. Bias in pharmacoepidemiologic studies using secondary health care databases: a scoping review. BMC Med Res Methodol 19, 53 (2019). https://doi.org/10.1186/s12874-019-0695-y
- Edouard L Fu, Merel van Diepen, Yang Xu, Marco Trevisan, Friedo W Dekker, Carmine Zoccali, Kitty Jager, Juan Jesus Carrero, Pharmacoepidemiology for nephrologists (part 2): potential biases and how to overcome them, Clinical Kidney Journal, Volume 14, Issue 5, May 2021, Pages 1317–1326, https://doi.org/10.1093/ckj/sfaa242
- Petitti DB. Hormone replacement therapy and heart disease prevention. JAMA 1998;280:650–2.
- Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/Progestin Replacement Study (HERS) Research Group. JAMA 1998;280:605–13.
- Herrington DM, Reboussin DM, Brosnihan KB, et al. Effects of estrogen replacement on the progression of coronary-artery atherosclerosis. N Engl J Med 2000;343:522–9.
- Grady D, Herrington D, Bittner V, et al. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/Progestin Replacement Study follow-up (HERS II). JAMA 2002;288:49–57.
- Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002;288:321–33.
- Wayne A. Ray, Evaluating Medication Effects Outside of Clinical Trials: New-User Designs, American Journal of Epidemiology, Volume 158, Issue 9, 1 November 2003, Pages 915–920, https://doi.org/10.1093/aje/kwg231
- Shrank WH, Patrick AR, Brookhart MA. Healthy user and related biases in observational studies of preventive interventions: a primer for physicians. J Gen Intern Med. 2011;26(5):546-550.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3077477/ - Yadav K, Lewis RJ. Immortal Time Bias in Observational Studies. JAMA. 2021;325(7):686–687.
https://jamanetwork.com/journals/jama/article-abstract/2776315 - Inhaled corticosteroids and the risk of mortality and readmission in elderly patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:580–584.
- Suissa S. Effectiveness of inhaled corticosteroids in chronic obstructive pulmonary disease: immortal time bias in observational studies. Am J Respir Crit Care Med. 2003 Jul 1;168(1):49-53.
- Khurana V, Bejjanki HR, Caldito G, Owens MW. Statins reduce the risk of lung cancer in humans: a large case-control study of US veterans. Chest. 2007;131:1282–1288.
- Suissa S, Dell’aniello S, Vahey S, Renoux C. Time-window bias in case-control studies: statins and lung cancer. Epidemiology. 2011 Mar;22(2):228-31.
- Catalog of Bias, “Confounding by indication”
https://catalogofbias.org/biases/confounding-by-indication/ - AndersenLW,RaymondTT,BergRA,etal. The association between tracheal intubation during pediatric in-hospital cardiac arrest and survival. JAMA.
- Kyriacou DN, Lewis RJ. Confounding by Indication in Clinical Research. JAMA. 2016 Nov 1;316(17):1818-1819.