- はじめに
- ENCePPとは
- チェックリストの目的
- チェックリストの構成
- 各論(セクション1~15の紹介)
- 【Section 1: Milestones】
- 【Section 2: Research question】
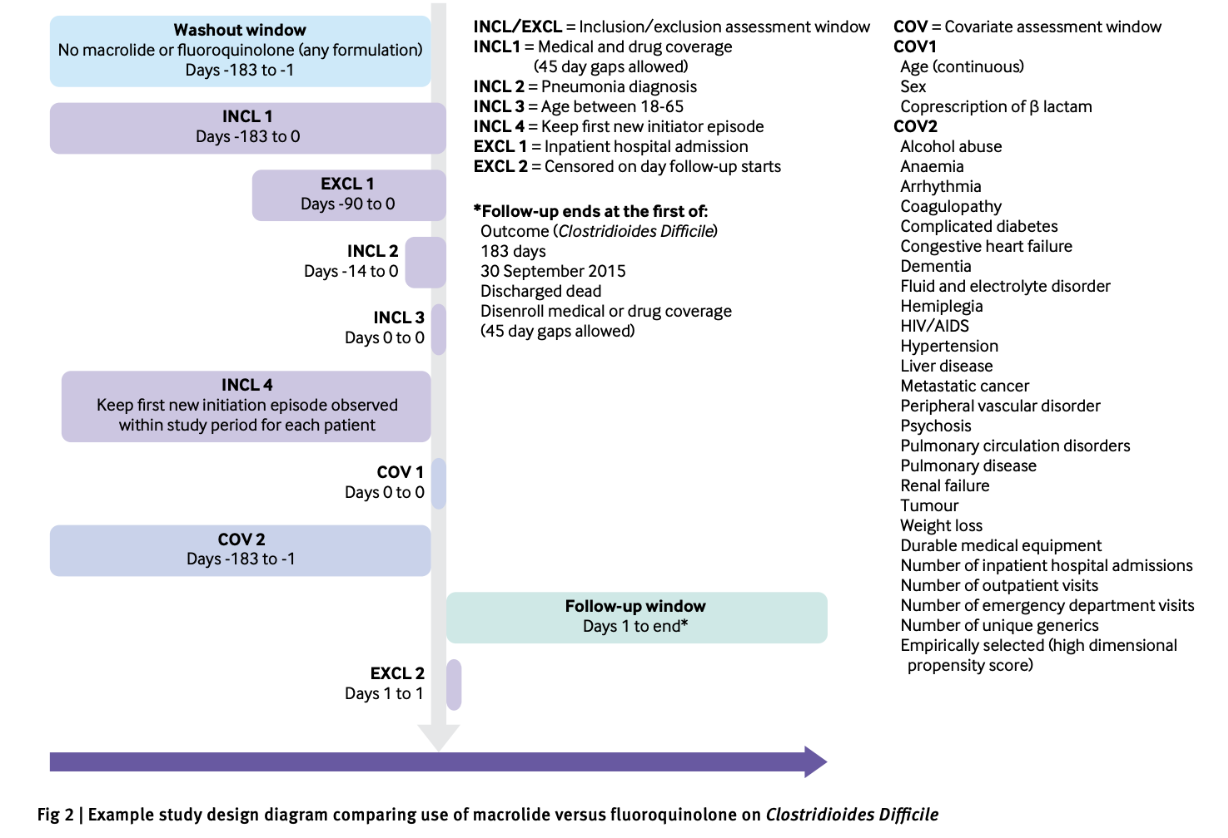
- 【Section 3: Study design】
- 【Section 4: Source and study populations】
- 【Section 5: Exposure definition and measurement】
- 【Section 6: Outcome definition and measurement】
- 【Section 7: Bias】
- 【Section 8: Effect measure modification】
- 【Section 9: Data sources】
- 【Section 10: Analysis plan】
- 【Section 11: Data management and quality control】
- 【Section 12: Limitations】
- 【Section 13: Ethical/data protection issues】
- 【Section 14: Amendments and deviations】
- 【Section 15: Plans for communication of study results】
- 最後に
はじめに
薬剤疫学研究のプロトコルを作成するにあたって、いくつかチェックリストが存在しています。その中でも、製薬企業の方が使用する上で、シンプルでわかりやすい薬剤疫学研究ネットワーク(ENCePP)のチェックリスト(ENCePP Checklist for Study Protocols)を紹介します。
ENCePPとは
ENCePP(The European Network of Centres for Pharmacoepidemiology and Pharmacovigilance) は、欧州医薬品庁(EMA) が欧州での医薬品市販後監視強化を目的として 2006 年に設立した、薬剤疫学とファーマコビジランス分野の研究ネットワークです。リアルワールドデータの情報提供や研究方法論のまとめ等、欧州で利用可能な研究リソースを活用するための支援を行っています。
<ENCePPの目的>
- 観察研究に重点を置いた、質の高い市販後調査の実施を促進すること。
- 欧州全域の薬剤疫学及びファーマコビジランスに関する専門知識とリソースを結集し、共同研究のためのプラットフォームを提供すること。
- 薬剤疫学及びファーマコビジランスにおける、研究のための方法論及びガバナンス原則を開発し、維持すること。
チェックリストの目的
ENCePP は、薬剤疫学/ファーマコビジランス研究のプロトコルを作成する際のチェックリストを開発しています(記事執筆時点ではRevision4が最新です)。欧州規制当局の監視下では、製造販売業者が市販後安全性試験(post-authorisation safety studies: PASS)の実施計画書を規制当局に提出する際の付属書として、このチェックリストを添付します。
とはいえ、欧州の規制当局に提出することを目的としない場合でも、このチェックリストは参考になります。それはこのチェックリストが以下のような目的で作成されているからです。
<チェックリストの目的>
- 薬剤疫学研究をデザインし、研究プロトコルを書く際に、重要な疫学的原則の確認漏れがないようにするため。
- 薬剤疫学研究で使用される方法論に関する透明性を促進するため。
- 薬剤疫学分野における科学と方法論の発展についての認識を深めるため。
チェックリストの構成
チェックリストは15のセクションで構成されています。
- Section 1: Milestones
- Section 2: Research question
- Section 3: Study design
- Section 4: Source and study populations
- Section 5: Exposure definition and measurement
- Section 6: Outcome definition and measurement
- Section 7: Bias
- Section 8: Effect measure modification
- Section 9: Data sources
- Section 10: Analysis plan
- Section 11: Data management and quality control
- Section 12: Limitations
- Section 13: Ethical/data protection issues
- Section 14: Amendments and deviations
- Section 15: Plans for communication of study results
各セクション内の質問について、それぞれ研究計画書に記載されているか否かをチェックします。答えが「Yes」の場合、その回答が書かれている研究計画書の該当セクション番号を明記します。もちろん、研究デザインによっては回答できない質問もあります。その場合は、「N/A」(Not Applicable)をチェックし、チェックリスト各セクション内の「Comments」欄にその理由を記入します。
各論(セクション1~15の紹介)
【Section 1: Milestones】
- 1.1 以下のスケジュールが設定されているか。
- 1.1.1 データ収集開始日
(研究で用いる情報が研究データセットに初めて記録された日。データの二次利用の場合は、データ抽出が開始された日。) - 1.1.2 データ収集完了日
(分析データセットが完全に利用可能になった日。) - 1.1.3 進捗状況報告書作成
- 1.1.4 中間報告書作成
- 1.1.5 EU PAS Register®への登録
- 1.1.6 最終報告書作成
- 1.1.1 データ収集開始日
【Section 2: Research question】
- 2.1 研究課題・目的の設定は明確に説明されているか。
- 2.1.1 なぜその研究を行うのか。
(例:公衆衛生上の重要な課題、リスク管理計画で特定されたリスクなど) - 2.1.2 研究の目的は何か。
- 2.1.3 target populationは何か。
(研究結果の一般化を意図している集団またはサブグループは何かということ。) - 2.1.4 どのような仮説を検証するのか?
- 2.1.5 先行する仮説が存在しないか?
(探索的な研究の場合は先行する仮説がない。)
- 2.1.1 なぜその研究を行うのか。
【Section 3: Study design】
- 3.1 研究デザインは記述されているか。
(例:コホート研究、ケースコントロール研究、クロスセクショナル研究など) - 3.2 一次データ、二次データ、複合データのいずれに基づく研究であるかが明記されているか。
- 3.3 頻度(occurrence)の尺度を明記しているか。
(例:rate, risk, prevalenceなど) - 3.4 関連性(association)の尺度を明記しているか。
(例:risk, odds ratio, excess risk, rate ratio, hazard ratio, risk/rate difference, number needed to harm など) - 3.5 有害事象/副作用の収集と報告の方法が記載されているか。
(例:一次データ収集の場合、収集されない有害事象など)
【Section 4: Source and study populations】
- 4.1 source populationが記述されているか。
- 4.2 計画している研究対象集団は、以下の観点で定義されているか。
- 4.2.1 研究期間
- 4.2.2 年齢・性別
- 4.2.3 国籍
- 4.2.4 疾患・適応症
- 4.2.5 フォローアップ期間
- 4.3 source populationから、研究対象集団がどのようにサンプル抽出されるかを定義しているか。
(例:包含/除外基準)
【Section 5: Exposure definition and measurement】
- 5.1曝露の定義と測定方法が記載されているか。
(例:曝露の定義と分類、投与量と曝露期間の測定の定義など) - 5.2 曝露測定の妥当性について言及しているか。
(例:precision、 accuracy、バリデーションサブスタディの使用など)。 - 5.3 曝露はtime windowを考慮して分類しているか。
- 5.4 曝露の程度は考慮されているか。
(例:投与量、投与期間など) - 5.5 生物学的作用機序に基づき、薬物動態学や薬力学を考慮して曝露が分類されているか。
- 5.6 適切な比較対象群が設定されているか。
【Section 6: Outcome definition and measurement】
- 6.1 プライマリアウトカムが明記されているか。
(該当する場合はセカンダリーアウトカムも明記する。) - 6.2 アウトカムの定義と測定の方法が記載されているか。
- 6.3 アウトカム測定の妥当性に言及しているか。
(例:precision、accuracy、感度、特異度、陽性的中度、バリデーションサブスタディの使用など) - 6.4 医療技術評価(Health Technology Assessment)に関連する具体的なアウトカムをプロトコルに記述しているか。
(例:HRQoL、QALYs、DALYS、医療サービスの利用、疾患や治療の負担、コンプライアンスなど)
【Section 7: Bias】
- 7.1 交絡を測定する方法を取り扱っているか。
(交絡の例:適応による交絡) - 7.2 選択バイアスに対処しているか。
(選択バイアスの例: healthy user/adherer bias) - 7.3 情報バイアスに対処しているか。
(情報バイアスの例:曝露とアウトカムの誤分類、時間関連バイアス)
【Section 8: Effect measure modification】
- 8.1 効果修飾因子に対処しているか。
(例:既知の効果修飾因子に関するデータの収集、サブグループ解析、予想される効果の方向性など)
【Section 9: Data sources】
- 9.1 研究で使用されたデータソースについて、以下の事項がどのように収集されたか記述しているか。
- 9.1.1 曝露
(例:薬局での調剤、一般診療所での処方、請求データ、自己申告、対面インタビューなど) - 9.1.2 アウトカム
(例:臨床記録、臨床検査値、請求データ、自己申告、患者インタビュー、人口統計など) - 9.1.3 共変量およびその他の特性
- 9.1.1 曝露
- 9.2 以下の事項について、データソースで利用できる情報について記述しているか。
- 9.2.1曝露
(例:調剤日、投与量、処方日数など) - 9.2.2 アウトカム
(例:発生日、アウトカムに関連するその他のイベント、重症度など) - 9.2.3 共変量およびその他の特性
(例:年齢、性別、既往歴、薬物使用歴、併存疾患、併用薬、ライフスタイルなど)
- 9.2.1曝露
- 9.3 以下の事項について、データソースで利用したコーディングシステムが記載されているか。
- 9.3.1 曝露
(例:WHO-ATC codeなど) - 9.3.2 アウトカム
(例:ICD、MedDRAなど) - 9.3.3 共変量およびその他の特性
- 9.3.1 曝露
- 9.4データソース同士のリンケージについて記述されているか。
(例:一意の識別子に基づいているなど)
【Section 10: Analysis plan】
- 10.1 統計手法とその選択理由が記述されているか。
- 10.2 試験の規模や統計的精度は推定されているか。
(サンプルサイズ設計のための効果量、検出力、有意水準の記述がされているか。) - 10.3 記述的な解析が行われているか。
- 10.4 層別解析が行われているか。
- 10.5 交絡の調整方法について記述されているか。
- 10.6 アウトカムの誤分類に対処する方法について記述されているか。
- 10.7 欠損データの取り扱い方法について記述されているか。
- 10.8 感度分析が行われているか。
【Section 11: Data management and quality control】
- 11.1 データ保存に関する情報が記述されているか。
(例:ソフトウェア、データベースのメンテナンス、不正防止対策、アーカイブなど) - 11.2 品質保証の方法が記述されているか。
- 11.3 研究結果をレビューするための独立したシステムがあるか。
【Section 12: Limitations】
- 12.1 以下のような解析結果への影響について議論されているか。
- 12.1.1 選択バイアスについて
- 12.1.2 情報バイアスについて
- 12.1.3 残余交絡、未測定交絡について
(例:予想されるバイアスの方向と大きさなど)
- 12.2 研究の実現可能性について言及されているか。
(例:研究規模、予想される曝露の程度、コホート研究における追跡期間、患者のリクルートメントなど)
【Section 13: Ethical/data protection issues】
- 13.1 倫理委員会/ 治験審査委員会(IRB)の要件事項が記載されているか。
- 13.2 倫理的審査手続きの結果について、何らかの対処がなされているか。
- 13.3 データ保護に関する要求事項が記載されているか。
【Section 14: Amendments and deviations】
- 14.1 プロトコル内に修正(amendments)と逸脱(deviations)を記録するセクションがあるか。
【Section 15: Plans for communication of study results】
- 15.1 研究結果の報告についての計画が記述されているか。
(例:規制当局への報告など) - 15.2 研究結果を外部に発信するための計画が記述されているか。
(例:論文投稿など)
最後に
ENCePPのチェックリストはシンプルに作成されているので、とても使いやすいと思います。研究の質や透明性を担保するためにも、是非ご活用ください。
※株式会社データックでは、プロトコル作成についてのご相談を受け付けています。こちらよりお問い合わせください。